علمی
لطفا برای پیشرفت وبلاگ در نظرسنجی ها شرکت کنیدعلمی
لطفا برای پیشرفت وبلاگ در نظرسنجی ها شرکت کنیدبیماری ایدز

ایدز (به انگلیسی: AIDS) یا سندرم نقص ایمنی اکتسابی (به انگلیسی: Acquired immune deficiency syndrome)، نوعی بیماری است که در دستگاه ایمنی و توسط ویروس نقص ایمنی (HIV) ایجاد میشود.[۱] در عفونت اولیه، فرد ممکن است برای مدت کوتاهی بیماری شبه آنفولانزایی را تجربه کند. به همین دلیل معمولاً این بیماری تا یک دوره طولانی بدون هیچ علائمی دنبال میشود. با گذشت زمان، این بیماری تداخل بیشتری با دستگاه ایمنی بدن پیدا میکند و باعث میشود که افراد به عفونتهایی مانند عفونت فرصتطلب و تومور دچار شوند که معمولاً روی دستگاه ایمنی افراد تاثیرگذار است.
HIV عمدتاً از طریقآمیزش جنسی محافظت نشده (مانند مقعدی و حتی دهانی)، انتقال خون آلوده و سرسوزن آلوده و از مادر به فرزند در طول بارداری، زایمان یا شیردهی منتقل میگردد.[۲] بعضی از مایعات بدن مانند بزاق و اشک قادر به انتقال HIV نیستند.[۳] پیشگیری از عفونت HIV، عمدتاً از طریق آمیزش جنسی امن و برنامه تعویض سرنگ، راه حلی برای جلوگیری از گسترش این بیماری محسوب میشوند. هیچ گونه درمان یاواکسن وجود ندارد؛ اگر چه درمان ضدویروسی می تواند باعث کاهش دوره بیماری و امید به زندگی نزدیک به طبیعی گردد. با وجود این که درمان ضدویروسی خطر مرگ و عوارض ناشی از این بیماری را کاهش می دهد، اما این داروها گرانقیمت هستند و ممکن است با عوارض جانبی همراه باشند.
تحقیقات ژنیتیکی نشان می دهد که HIV در اصل متعلق به غرب آفریقا و در اوایل قرن بیستم بوده است.[۴] ایدز اولین بار در سال ۱۹۸۱ توسطمرکز کنترل و پیشگیری بیماری (CDC) شناخته شد و عامل آن (عفونت HIV) در اوایل دهه شناخته شده بود..[۵]از زمان کشف آن، ایدز باعث مرگ ۳۰ میلیون نفر شده است (تا سال ۲۰۰۹).[۶] تا سال ۲۰۱۰، حدوداً ۳۴ میلیون نفر به ایدز مبتلا بودهاند.[۷] ایدز به عنوان همهگیری جهانیشناخته میشود که در حال حاضر حوزه شیوع آن بسیاره وسیع و در حال گسترش است.[۸]
ایدز تاثیر بسیار زیادی بر روی جوامع داشتهاست، چه به عنوان یک بیماری و چه به عنوان عاملی برای تبعیض. همچنین تاثیرات اقتصادی قابل توجهی داشته است. تصورهای نادرست بسیاری در رابطه با ایدز وجود دارد، برای مثال انتقال ایدز از طریق رابطههای سطحی غیرجنسی.
این بیماری همچنین موضوع مجادله ادیان شده است.
تاریخچه
ایدز اولین بار در سال ۱۹۸۱ در امریکا مشاهده شد. اولین مواردی که مشاهده شد در بین معتادان تزریق سرنگ و همچنین همجنسگرایان مرد قرار داشت که به دلیل نامعلومی سیستم دفاعی بدن آنها ضعیف شده بود و علایم بیماری التهاب ریه نیوموسیستیک کارینی (PCP) در آنها مشاهده میشد که این بیماری در افرادی دیده میشود که سیستم دفاعی بدنی ضعیفی دارند.[۹]سپس نوعی سرطان پوست نادر با نام کاپوسی سارکوما (KS) در میان مردان همجنسگرای گزارش شد.[۱۰] موارد بیشتری از بیماری PCP و KS مشاهده شد و این زنگ خطری برای مرکز پیشگیری و کنترل بیماری بود و گروهی از طرف این مرکز برای بررسی این واقعه تشکیل شد.[۱۱]
محققان معتقدند که هر دو ویروس HIV-1 و HIV-2 در اصل متعلق به نخستیسانان مرکز افریقا بوده و در اوایل قرن بیست به بدن انسان منتقل شدهاست.[۱۲] به نظر میآید که ویروس HIV-1 در اصل متعلق به مناطق جنوبی کامرون و تکامل یافتهٔ ویروس SIV (ویروس نقص ایمنی میمونی) که در میان شمپانزههای وحشی شیوع دارد، بودهاست.[۱۳] همچنین ویروس HIV-2 تکامل یافتهٔ ویروس SIV میان گونهای میمون به نام منگابی دودی بودهاست که در غرب افریقا (از جنوب سنگال تا غرب ساحل عاج) زندگی میکردهاست.[۱۴] پخبینیانی مانند میمون شب نسبت به ویروس HIV-1 مقاوم هستند و این احتمالاً به دلیل یک نوع ژن پیوندی دو گونه مقاوم ویروس در آنها میباشد.[۱۵]
مدارکی موجود است که نشان میدهد انسانهایی که در شکار و یا فروش حیوانات دخالت داشتند دچار ویروس SIV شدهاند.[۱۶] اگرچه SIV ویروس ضعیفی است که سیستم دفاعی بدن انسان با آن مقابله میکند و بیش از چند هفته در بدن انسان باقی نمیماند، اما انتقال سریع و متوالی آن بین انسانهای مختلف زمان کافی را به این ویروس برای تبدیل آن به HIV میدهد.[۱۷]
بررسی نمونههای خونی به جا مانده از گذشته نشان میدهد که اولین انسانی که مبتلا به ایدز شده در سال ۱۹۵۹ کنگو جان خود از دست دادهاست. این نخستین و قدیمیترین مورد مرگ شناخته شده در اثر ابتلا به این بیماری محسوب میشود.[۱۸] همچنین ممکن است ویروس اچآیوی نخستین بار در سال ۱۹۶۶ به آمریکا رسیده باشد.[۱۹] ولی عمده شیوع HIV مربوط به خارج از صحرای آفریقا (و همچنین امریکا) میشود و میتوان آن را به فردی ناشناس و مبتلا به ایدز نسبت داد که در هائیتی زندگی میکردهاست و با ورود به امریکا در سال ۱۹۶۹ به آن شیوع بخشیدهاست.[۲۰] پس از آن به سرعت بین گروههای پرخطر (در ابتدا در بین مردان همجنسگرا) پخش شد. در سال ۱۹۷۸ شیوع ویروس HIV-1 در بین مردان همجنسگرای مقیم نیویورک و سان فرانسیسکو، ۵ درصد تخمین زده شد که بیانگر این است که هزاران نفر در کشور مبتلاً به ایدز بودهاند.[۲۰]
در آن اوایل مرکز کنترل بیماری هنوز نامی رسمی برای این بیماری انتخاب نکرده بود و معمولاً نام این بیماری را با بیماری که مریض با آن در ارتباط بود بیان میکردند.[۲۱] همچنین اسامی مانندسارکوم کاپوزی یا عفونت فرصتطلب نامهایی بودهاند که توسط این گروه در سال ۱۹۸۱ استفاده میشدهاست.[۲۲] واژه ایدز یا سندرم نقص ایمنی اکتسابی اولین بار در سال ۱۹۸۲ توسط پژوهشگران مرکز پیشگیری و کنترل بیماری در آتلانتا به کار برده شد. تا پایان سال ۱۹۸۲، مواردی از ابتلا به بیماری ایدز در ۵ قاره جهان شناسایی شد. همچنین مشخص شد که یک بیماری که در آفریقا به عنوان «بیماری لاغری» شناخته میشد، در واقع شکلی از بیماری ایدز است. در سال ۱۹۸۴ لوک مونتانیه در انستیتو پاستور پاریس و رابرت گالو در انستیتو ملی سرطان در واشنگتن، به طور جداگانه ویروس مولد ایدز را کشف کردند که این ویروس بعداً «ویروس نقص ایمنی انسانی» یا اچآیوی نامیده شد. همچنین مواردی از انتقال بیماری ایدز در اثر رابطه جنسی میان دو جنس مخالف نمایان شد.[۲۳]
تا پایان سال ۱۹۸۷، در آمریکا ۱۶ هزار و ۹۰۸ نفر در اثر ابتلا به ایدز جان خود را از دست دادند. تا این زمان، سازمان جهانی بهداشت (WHO) کل موارد ابتلا به بیماری ایدز در جهان را ۷۱ هزار و ۷۵۱ نفر و تعداد کل مبتلایان به این بیماری را در آمریکا ۴۷ هزار و ۲۲ نفر گزارش کرده بود.[۲۳] سازمان جهانی بهداشت با این تخمین که ممکن است ۵ تا ۱۰ میلیون نفر در سراسر جهان به ویروس اچآیوی مبتلا باشند، برنامه جهانی ایدز خود را راهاندازی کرد که بعدها در سال ۱۹۹۶ جای خود را به برنامه مشترک سازمان ملل متحد برای مقابله با ایدز (UNAIDS) داد. در سال ۱۹۸۸ سازمان جهانی بهداشت نخستین روز از ماه دسامبر را به عنوان روز جهانی ایدز نامگذاری کرده و روبان قرمز به عنوان یک نماد بینالمللی برای ایدز معرفی شد.[۲۳]
علائم و نشانهها [ویرایش]
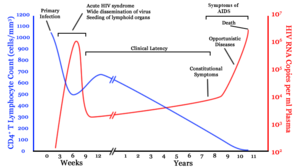
عفونت HIV دارای سه مرحله اصلی است: عفونت حاد، دوره نهفتگی و ایدز[۲۴][۲۵]
عفونت حاد [ویرایش]
دوره اولیه HIV، عفونت حاد HIV و یا سندرم حاد ویروسی نامیده میشود.[۲۴][۲۶] بسیاری از افراد ۲ تا ۴ هفته پس از در معرض قرار گرفتن این بیماری، دچار بیماریهایی مانند شبهآنفلوانزا یا مونونوکلئوز میشوند و برخی دیگر هم هیچ نشانه قابل توجهی در آنها دیده نمیشود.[۲۷][۲۸]علائم در ۴۰ تا ۹۰ درصد موارد رخ میدهد و معمولا شامل تب، لنفادنوپاتی، فارنژیت، خارش پوست، سردرد و/یا زخم دهان و اندام تناسلی میشود.[۲۶][۲۸] خارش پوست که در ۲۰ تا ۵۰ درصد موارد رخ میدهد، خود را بر روی بالاتنه نشان میدهد و به شکل لکههای نوک تیز میباشد.[۲۹] همچنین در این مرحله برخی از افراد دچار عفونتهای فرصتطلب میشوند.[۲۶] ممکن است در دستگاه گوارش علائمی مانند تهوع، استفراغ و یا اسهال رخ دهد، و همچنین علائم عصبی نوروپاتی محیطی و یا سندرم گیلان باره.[۲۸] طول دوره این علائم متفاوت است، اما معمولا یک یا دو هفته میباشد.[۲۸]
با توجه به اینکه این علائم آنچنان خاص نیستند، اغلب به عنوان نشانههایی از عفونت HIV شناخته نمیشوند. حتی مواردی که توسط یک دکتر خانوادگی و یا یک بیمارستان دیده میشود اغلب یا بسیاری از بیماریهای شایع عفونی با علائمی مشترک با آن اشتباه میشود. بنابراین، توصیه میشود که به بیماران دارای تب توجیهناپذیر است تذکر داده شود که ممکن است دارای عفونت HIV باشند و خطر ابتلا به این عفونت در آنها وجود دارد.[۲۸]
دوره نهفتگی [ویرایش]
پس از علائم اولیه، بیمار وارد مرحلهای به نام دوره نهفتگی یا HIV بینشانه یا HIV مزمن میشود.[۲۵] این مرحله از HIV میتواند بدون هیچ گونه درمانی از حدود سه سال[۳۰] تا بیش از ۲۰ سال[۳۱] (به طور متوسط حدود هشت سال)[۳۲] به طول بیانجامد. اگرچه معمولاً در ابتدای بیماری هیچ علائمی مشاهده نمیشود و یا علامتهای خیلی کمی دیده میشود، اما در نزدیکی پایان این مرحله بسیاری از افراد دچار تب، کاهش وزن، مشکلات گوارشی و دردهای عضلانی میشوند.[۲۵] همچنین ۵۰ تا ۷۰ درصد از افراد دچار لنفادنوپاتی ماندگار میشوند، بطوری که چند گروه از غدد لنفاوی (به جز در کشاله ران) به مدت بیش از سه تا شش ماه بدون هیچ درد و به طور توجیهناپذیری بزرگ میشود.[۲۴]
اگر چه بسیاری از مبتلایان HIV-1، قابل تشخیص هستند و در صورت عدم درمان نهایتاً به ایدز منجر خواهد شد، ولی درصد کمی از آنها (حدود ۵٪) سطح بالای سلولهای CD4+ T خود را بدون هیچ درمان ضدویروسی تا بیش از ۵ سال حفظ میکنند.[۲۸][۳۳] این افراد به عنوان کنترل کنندههای HIV طبقه بندی میشوند، و آنهایی که مقدار کم یا غیر قابل محسوسی از ویروس را بدون درمان ضدویروسی در بدن خود نگه میدارند به عنوان «کنترل کنندگان ممتاز» یا «سرکوبگران ممتاز» شناخته میشوند.[۳۳]
سندرم نقص ایمنی اکتسابی [ویرایش]
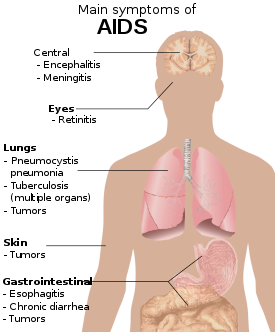
سندرم نقص ایمنی اکتسابی (ایدز) زمانی معنی پیدا میکند که شمار سلولهای CD4+ T به کمتر از ۲۰۰ سلول در هر میکرولیتر برسد و یا بیماریهای خاص مرتبط با عفونت HIV رخ دهد.[۲۸] در غیاب درمان، حدود نیمی از افراد مبتلا به HIV در عرض ده سال مبتلا به بیماری ایدز میشوند.[۲۸] رایج ترین وضعیتهایی که هشداری بر وجود ایدز هستند التهاب ریه ناشی از پنوموسیستیس (۴۰٪)، نزاری به شکل سندرم اتلاف اچآیوی (۲۰٪) و کاندیدیاز مری میباشند. سایر علائم شایع شامل عفونتهای دستگاه تنفسی در یک دوره زمانی معین میشود.[۲۸]
عفونت فرصتطلب ممکن است توسط باکتری، ویروس، قارچ و انگل به وجود بیاید که معمولاً توسط دستگاه ایمنی بدن کنترل میشود.[۳۴]اینکه کدام عفونت رخ میدهد تا حدودی به این بستگی دارد چه عواملی در محیط اطراف فرد قرار دارد.[۲۸] این عفونت تقریباً میتواند هردستگاهی از بدن را تحت تاثیر قرار دهد.[۳۵]
افراد مبتلا به ایدز خطر آلودگی به ویروسهای سرطانی مختلفی را دارند از جمله: سارکوم کاپوزی، سرطان لنفوم، دستگاه عصبی مرکزی لنفوم، و سرطان گردن رحم. [۲۹] سارکوم کاپوزی، شایع ترین سرطانی است که در ۱۰ تا ۲۰ درصد از افراد مبتلا به HIV اتفاق میافتد. [۳۶]پس از آن سرطان لنفوم شایع ترین سرطان است و علت مرگ نزدیک به ۱۶ درصد از افراد مبتلا به ایدز میباشد و جزء نشانههای اولیه ۳ تا ۴ درصد از آنها است. هر دوی این سرطانها با ویروس هرپس ۸ انسانی همراه هستند.[۳۶] خیلی اوقات مبتلایان به ایدز به دلیل ارتباطی که باویروس پاپیلوم انسانی (HPV) دارد، دچار سرطان گردن رحم میشوند.[۳۶]
علاوه بر این، آنها به طور مکرر دچار علائمی مانند تب طولانی، تعریق شبانه، تورم غدد لنفاوی، لرز، ضعف، و کاهش وزن میشوند. [۳۷]اسهال یکی دیگر از علائم شایعی است که ۹۰٪ از افراد مبتلا به ایدز دچار آن میشوند. [۳۸]
راههای انتقال [ویرایش]
| طریق انتقال | احتمال سرایت | |||
|---|---|---|---|---|
| انتقال خون | ۹۰%[۳۹] | |||
| زایمان (فرزند) | ۲۵%[۴۰] | |||
| تزریق با آمپول مشترک | ۰.۶۷%[۳۹] | |||
| فرو رفتن آمپول در بدن | ۰.۳۰%[۴۱] | |||
| رابطه جنسی مقعدی (دهنده)* | ۰.۰۴–۳.۰%[۴۲] | |||
| رابطه جنسی مقعدی (واردکننده)* | ۰.۰۳%[۴۳] | |||
| رابطه جنسی آلت-واژن (دهنده)* | ۰.۰۵–۰.۳%[۴۲][۴۴] | |||
| رابطه جنسی آلت-واژن (واردکننده)* | ۰.۰۱–۰.۳۸%[۴۲][۴۴] | |||
| رابطه جنسی دهانی (دهنده)*§ | ۰–۰.۰۴%[۴۲] | |||
| رابطه جنسی دهانی (واردکننده)*§ | ۰–۰.۰۰۵%[۴۵] | |||
| * با فرض عدم استفاده از کاندوم § منبع به رابطه جنسی دهانی انجام شده روی یک مرد اشاره دارد | ||||
HIV از سه طریق اصلی انتقال مییابد:
- تماس جنسی
- قرار گرفتن در معرض خون و یا بافت آلوده
- از مادر به فرزند در دوران بارداری، زایمان، یا تغذیه با شیر مادر (که با نام انتقال عمودی شناخته میشود)[۲]
هیچ گونه خطر انتقال از طریق ویروس مدفوع، ترشحات بینی، بزاق، خلط، عرق، اشک، ادرار، یا استفراغ وجود ندارد مگر اینکه با خون آلوده شده باشند.[۴۱]
تماس جنسی [ویرایش]
شایعترین حالت انتقال HIV از طریق تماس جنسی با فرد آلودهاست.[۲] اکثر موارد انتقال HIV در سراسر دنیا از طریق تماس با جنس مخالف رخ میدهد. با این حال، شکل انتقال در هر کشور متفاوت است.[۲] در ایالات متحده، از سال ۲۰۰۹، بیشتر انتقالهای جنسی در مردان همجنسگرا رخ داده است[۲]، که ۶۴٪ از تمام موارد مشاهده شده رو شامل میشود.[۴۶]
در مورد تماس محافظت نشده با جنس مخالف، تخمین خطر انتقال HIV در هر عمل جنسی در کشورهای کم درآمد چهار تا ده برابر بیشتر نسبت به کشورهای با درآمد بالا است.[۴۷] در کشورهای با درآمد کم، خطر ابتلا از زن به مرد انتقال به ۰٫۳۸٪ در هر بار نزدیکی و از مرد به زن ۰٫۳۰٪ در هر بار نزدیکی تخمین زده شدهاست. این تخمین برای کشورهای با درآمد بالا، ۰٫۰۴٪ در هر بار نزدیکی برای انتقال از زن به مرد و ۰٫۰۸٪ در هر بار نزدیکی از مرد به زن میباشد.[۴۷] خطر انتقال از مقاربت مقعد بیشتر است، و ۱٫۴ تا ۱٫۷ درصد در هر بار نزدیکی با جنس مخالف یا همجنسگرا تخمین زده شدهاست.[۴۷] اگرچه خطر ابتلا از طریقآمیزش جنسی دهانی نسبتاً کم است، اما این احتمال وجود دارد.[۴۸] خطر انتقال از طریق رابطه دهانی «نزدیک به صفر» توصیف شده است[۴۹]، اگر چه چند موردی گزارش شدهاست.[۵۰] خطر ابتلا از طریق سکس دهانی صفر تا ۰٫۰۴ درصد تخمین زده شدهاست.[۵۱] در محیطهایی عمومی مانند روسپیها، خطر انتقال از زن به مرد ۲٫۴٪ در هر بار نزدیکی و از مرد به زن ۰٫۰۸ درصد در هر بار نزدیکی تخمین زده شدهاست.[۴۷]
خطر انتقال در حضور بیماریهای آمیزشی[۵۲] و زخم تناسلی[۴۷] افزایش مییابد. به نظر میرسد زخم تناسلی خطر ابتلا را تا حدود پنج برابر افزایش میدهد.[۴۷] بیماریهای مقاربتی دیگر مانند سوزاک، کلامیدیا، تریکومونا، و واژینوز باکتریال، به نسبت کمتری خطر انتقال را افزایش میدهند.[۵۱]
بار ویروسی از فرد آلوده نیز عامل مهمی است که در انتقال از طریق تماس جنسی (و همچنین از طریق مادر به فرزند) نقش دارد.[۵۳] در طول ۲٫۵ ماه اول از عفونت، میزان سرایت به دلیل بار زیاد ویروسی، ۱۲ برابر بیشتر است.[۵۱] در مراحل آخر عفونت فرد، میزان انتقال در حدود هشت برابر بیشتر است.[۴۷]
رابطه جنسی خشن میتواند یکی از عوامل موثر در افزایش خطر انتقال باشد.[۵۴] همچنین گفته میشود تجاوز جنسی خطر انتقال HIV را افزایش میدهد چرا که در این حالت به ندرت از کاندوم استفاده میشود، آسیب فیزیکی واژن و یا مقعد محتمل است، و ممکن است خطر بیشتری برای انتقال همزمان عفونتهای جنسی وجود داشته باشد.[۵۵]
خون [ویرایش]
دومین عامل شایع انتقال HIV، از طریق خون و فرآوردههای خونی است.[۲] از راههایی که ممکن است این بیماری توسط خون منتقل گردد میتوان آمپول مشترک در مواد مخدر تزریقی، زخم در اثر فرو رفتن آمپول، انتقال خون آلوده و یا فرآوردههای خونی، و یا تزریقهایی که با استفاده از تجهیزات پزشکی استریل نشده انجام میشود را نام برد. خطر آمپول مشترک در حین تزریق مواد مخدر بین ۰٫۶۳ و ۲٫۴ درصد و به طور متوسط ۰٫۸٪ در هر عمل میباشد.[۵۶] خطر انتقال از فرو رفتن آمپول یک فرد آلوده ۰٫۳٪ در هر عمل (حدود ۱ در ۳۳۳) و خطر آلودگی غشاء مخاطی به خون آلوده ۰٫۰۹٪ در هر عمل (حدود ۱ در ۱۰۰۰) تخمین زده میشود.[۴۱] در ایالات متحده، مصرف کنندگان مواد مخدر تزریقی ۱۲٪ از مبتلایان به HIV در سال ۲۰۰۹ را تشکیل میدادند[۴۶] و در برخی مناطق بیش از ۸۰٪ از افرادی که تزریق مواد انجام میدهد دارای HIV هستند.[۲]
در ۹۳٪ موارد استفاده از خون آلوده در انتقال خون، انتقال عفونت خواهد بود.[۵۶] در کشورهای توسعه یافته خطر ابتلا به HIV از طریق انتقال خون بسیار پایین است (کمتر از یک در پانصدهزار) و در آنها آزمایش HIV بر روی خون اهدا کننده انجام میشود.[۲] در انگلیس، خطر انتقال یک در پنج میلیون گزارش شدهاست.[۵۷] با این حال، در کشورهای با درآمد پایین، تنها نیمی از خون مورد استفاده برای انتقال ممکن است به طور مناسب آزمایش شود (در سال ۲۰۰۸).[۵۸] تخمین زده شدهاست که HIV در این مناطق تا ۱۵٪ از طریق انتقال خون آلوده و فراوردههای خونی سرایت مییابد، که نمایانگر ۵٪ تا ۱۰٪ از عفونتهای سرتاسر دنیا است.[۲][۵۹]
تزریق غیربهداشتی نقش مهمی در گسترش HIV در کشورهای جنوب صحرای آفریقا دارد. در سال ۲۰۰۷، بین ۱۲ تا ۱۷ درصد از عفونتهای این منطقه به دلیل استفاده از سرنگ نسبت داده شد.[۶۰] سازمان بهداشت جهانی خطر انتقال از طریق تزریق در آفریقا را ۱٫۲٪ تخمین زدهاست.[۶۰]
افرادی که خالکوبی، سوراخکاری و زخمآرایی انجام میدهند از نظر تئوری در معرض خطر سرایت هستن، اما تاکنون هیچ مورد مستندی مشاهده نشدهاست.[۶۱] پشهها و سایر حشرات دیگر نیز قادر به انتقال HIV نیستند.[۶۲]
مادر به فرزند [ویرایش]
انتقال HIV از مادر به فرزند میتواند در دوران بارداری، در هنگام زایمان یا از طریق شیر مادر منتقل شود.[۶۳][۶۴] این عامل سومین عامل شایع انتقال HIV در دنیا میباشد.[۲] در صورت عدم درمان، خطر انتقال قبل یا در حین تولد حدود ۲۰ درصد و در کسانی که از شیر نیز تغذیه میدهند ۳۵ درصد است.[۶۳] در سال ۲۰۰۸، در حدود ۹۰٪ از موارد HIV کودکان ناشی از انتقال عمودی محاسبه شد.[۶۳] با درمان مناسب خطر ابتلا به عفونت از مادر به فرزند میتواند به حدود ۱٪ کاهش یابد.[۶۳] درمان از طریق پیشگیری شامل مصرف داروی ضد ویروسی توسط مادر در دوران بارداری و زایمان، عمل سزارین در زمان مناسب (و نه اضطراری)، عدم تغذیه شیر مادر، و تجویز داروهای ضد ویروسی به نوزاد میشود.[۶۵] با این حال بسیاری از این امکانات در کشورهای در حال توسعه در دسترس نیست.[۶۵] اگر در دوران دندان آوردن، مواد غذایی به خون آلوده شود، میتواند خطر انتقال را افزایش دهد.[۶۱]
ویروسشناسی [ویرایش]
ویروس HIV عامل طیف بیماری است که با نام ایدز شناخته میشود. HIV نوعی ویروس پسگرد است که عمدتاً به اجزای دستگاه ایمنی انسان مانند سلولهای CD4+ T، درشتخوارها و سلولهای دندریت سرایت میکند و به صورت مستقیم یا غیرمستقیم سلولهای CD4+ T را از بین میبرد.[۶۶]
HIV عضوی از سرده ویروس آهستهگستر ،[۶۷] و بخشی از خانواده ویروس پسگرد است.[۶۸] ویروسهای آهستهگستر خصوصیات ریختشناسیوزیستشناسی مشترک بسیاری دارند. گونههای بسیاری از پستانداران مبتلا به ویروس آهستهگستر میشوند، که مشخصاً دلیل بیماریهای طولانیمدت با دوره کمون طولانی هستند.[۶۹] ویروسهای آهستهگستر به شکل تک رشته، حس مثبت، ویروس آرانای احاطه شده منتقل میشوند. پس از ورود به سلول هدف، ویروس ژنوم آرانای توسط آنزیم وارونویس ویروسی که همراه با ژنوم ویروسی در ذرات ویروسی منتقل شده، به یکدیانای دو رشته استاندارد تبدیل میشود. سپس DNA ویروسی وارد هسته سلول میشود و کل DNAهای سلولی را توسط اینتگراز ویروسی فرا میگیرد.[۷۰] وقتی فرا گرفته شد، ویروس ممکن است پنهان شود و این به ویروس و سلولهای میزبانش این امکان را میدهد تا توسط دستگاه ایمنی بدنی شناسایی نشوند. [۷۱] همچنین این ویروس میتواند تکثیر شود و ژنومهای RNA جدیدی تولید کند و پروتئینهای ویروسی که توسط سلول به عنوان هستههای سلولی جدید شدهاند را در چرخهای از نو پدید آورد.[۷۲]
دو نوع ایدز تاکنون مشخص شدهاست: HIV-1 و HIV-2.
HIV-1 ویروسی بود که در ابتدا شناخته شد (و در ابتدا به عنوان LAV یا HTLV-III شناخته میشد). هر چه بیشتربدخیم باشد، بیشتر عفونی میشود،[۷۳]. عفونت ضعیفترHIV-2 در مقایسه با HIV-1 افرادی که در معرض HIV-2 هستند کمتر مبتلا به HIV-2 میشوند. از آنجا که HIV-2 توانایی ضعیفی در مقابل انتقال دارد، تا حد زیادی محدود به آفریقای غربی میباشد.[۱۴]
پاتوفیزیولوژی [ویرایش]
پس از ورود ویروس به بدن، یک دوره سریع تکثیر ویروسی وجود داشته و منجر به بالا رفتن تعداد ویروس در خون اطراف خود خواهد شد. در طی عفونت اولیه، سطح HIV ممکن است به چند میلیون ذره ویروس در هر میلی لیتر خون برسد.[۷۴] این واکنش با کاهش قابل توجهی در تعداد سلولهای در گردش CD4+ T همراه است. این ویروس خونی حاد تقریباً همواره با فعالیت سلولهای CD8+ T در ارتباط است که سلول های آلوده به HIV را از بین میبرد و سپس آنتیبادی تولید میکند. به نظر میرسد که واکنش سلول CD8+ T در کنترل سطح ویروس مهم باشد، که به اوج رسیده و سپس کاهش مییابد، تا شمار سلولهای CD4+ T به مقدار قبل بازگردد. واکنش یک سلول CD8+ T سالم هر چند که ویروس را از بین نمی برد اما باعث میشود بیماری با سرعت کمتری پیشرفت کند و بهتر بتوان بیماری را شناسایی کرد.[۷۵]
پاتوفیزیولوژی بیماری ایدز پیچیده است.[۷۶] در نهایت، HIV با به تحلیل بردن سلولهای CD4+ T منجر به ایدز شده و باعث تضعیف دستگاه ایمنی بدن وعفونت فرصتطلب میشود. وجود سلول های T برای واکنش ایمنی ضروری است و بدون آنها، بدن نمیتواند با عفونتها مقابله کند و یا سلولهای سرطانی را از بین ببرد. عملکرد کاهش سلولهای CD4+ T در وضعیت حاد و مزمن متفاوت است. [۷۷] در حین وضعیت حاد، سلولهای HIV ناشی از سلولهای عفونی تحلیل رفته و کشته شده توسط سلولهای سمی T، عامل کاهش سلول های CD4+ T هستند، اگر چه عامل دیگر میتواند مرگ برنامهریزیشده یاخته باشد. در حین وضعیت مزمن، به نظر می رسد که عواقب ناشی از فعالیت کلی دستگاه ایمنی بدن همراه با از دست دادن تدریجی توانایی دستگاه ایمنی بدن برای تولید سلولهای جدید T عامل کاهش تدریجی تعداد سلولهای CD4+ T باشد. [۷۸]اگر چه علائم نقص دستگاه ایمنی توسط ایدز تا چند سال بعد از عفونت در فرد ظاهر نخواهد شد، ولی نقصان سلولهای CD4+ T در طول هفته اول عفونت، به خصوص در مخاط روده، که منبع اکثریت لنفوسیتهای موجود در بدن است، اتفاق میافتد. .[۷۹] دلیل اصلی از دست رفتن سلولهای مخاطی CD4+ T این است که اکثر سلولهای مخاطی CD4+ T نشان دهنده پروتئین CCR5 هستند که HIV از آنها برای دستیابی به سلولها استفاده میکند، در حالی که تنها بخش کوچکی از سلولهای CD4+ T در جریان خون این کار را انجام میدهند.[۸۰]
ویروس HIV به دنبال CCR5 نشانگر CD4+ T میگردد و آنها را از بین می برد[۸۱] در نهایت واکنش شدید دستگاه ایمنی، عفونت را کنترل میکند و مرحله نهفتگی بالینی آغاز میگردد. سلولهای. CD4+ T در بافت مخاطی باقی میمانند. .[۸۱] تکثیر مداوم HIV از وضعیت کلی فعالیت ایمنی حاصل میشود.[۸۲] فعالیت دستگاه ایمنی که نمایانگر افزایش فعالیت سلولهای ایمنی و التهابسیتوکین است، از فعالیت چندین محصول ژن HIV و واکنش دستگاه ایمنی به تکثیر HIV حاصل میشود. همچنین از کار افتادن دستگاه ایمنی گوارشی به وسیله تکثیر سلولهای مخاطی CD4+ T در طی مرحله عفونی بیماری به این موضوع مربوط میشود.[۸۳]
تشخیص بیماری [ویرایش]
بیماری ایدز و HIV با توجه بروز علایم و نشانههای بیمار، از طریق آزمایش و بررسی آن در آزمایشگاه تشخیص داده میشود.[۲۶] آزمایش HIV به همه کسانی که در معرض خطر قرار دارند توصیه میشود، که شامل هر فرد مبتلا به هر نوع بیماری آمیزشی است میشود.[۲۹]در بسیاری از مناطق دنیا، یک سوم حاملان HIV زمانی متوجه میشوند که در مرحله پیشرفتهای از این بیماری هستند و AIDS یا نقص شدید دستگاه ایمنی آشکار میشود.[۲۹]
آزمایش HIV [ویرایش]
در اکثر افراد آلوده به HIV، در طول سه تا دوازده هفته پس از عفونت اولیه، یک سری آنتیبادیهای خاص ایجاد میگردد.[۲۸] تشخیص اولیه HIV قبل از تغییر آنتیبادی، با اندازهگیری اچآیوی-آرانای یا آنتیژن P24 انجام میشود.[۲۸] نتایج مثبت به دست آمده توسط آنتیبادی یا آزمایش واکنش زنجیرهای پلیمراز (PCR)، توسط PCR و یا توسط آنتیبادی دیگری تأیید میشوند.[۲۶]
آزمایش آنتیبادی در کودکان کمتر از ۱۸ ماه، به دلیل وجود مداوم آنتیبادیهای مادری معمولاً نتیجه درستی نمیدهند.[۸۴] بنابراین عفونت HIV تنها توسط آزمایش PCR مربوط به HIV RNA یا DNA و یا از طریق آزمایش آنتیبادی P24 قابل تشخیص است.[۲۶] در اکثر نقاط دنیا دسترسی به آزمایش PCR قابل اعتماد وجود ندارد و افراد باید تا زمانی صبر کنند که علائم پیشرفت کند و یا سن کودک به اندازه کافی باشد و آزمایش آنتی بادی درستی نتیجه دهد.[۸۴] در کشورهای جنوب صحرای آفریقا در بین سالهای ۲۰۰۷ و ۲۰۰۹، بین ۳۰ تا ۷۰ درصد مردم، از وضعیت HIV خود آگاه بودهاند.[۸۵] در سال ۲۰۰۹، بین ۴ تا ۴۲ درصد مردم مورد آزمایش قرار گرفتند.[۸۵] این ارقام نشان دهنده افزایش قابل توجهی نسبت به ده سال گذشتهاست.[۸۵]
طبقهبندی عفونت HIV [ویرایش]
از دو طبقهبندی اصلی برای مرحلهبندی HIV و ایدز استفاده میشود، یکی توسط سازمان بهداشت جهانی[۲۶] (WHO) و دیگر توسط مرکز کنترل و پیشگیری بیماری[۸۶] (CDC). برنامه CDC بیشتر در کشورهای توسعهیافته استفاده میشود. از آنجا که برنامه WHO احتیاجی به آزمایش ندارد، بیشتر مناسب کشورهای در حال توسعهاست که با کمبود لوازم روبرو هستند. علیرغم تفاوتهای که این دو با هم دارند، اما میتواند هر دوی آنها را از لحاظ آماری مقایسه نمود.[۲۴][۲۶][۸۶]
سازمان بهداشت جهانی برای اولین بار در سال ۱۹۸۶ تعریفی برای ایدز ارائه نمود.[۲۶] از آن زمان به بعد، مرحلهبندی WHO برای چندین بار تغییر کرده و گسترش یافت، که نسخهٔ اخیر آن که در سال ۲۰۰۷ منتشر شدهاست.[۲۶] ردهبندی مراحل تعیین شده توسط WHO به شکل زیر است:
- عفونت اولیه HIV: که یا بدون علامت است و یا همراه با سندرم حاد ویروسی است.[۲۶]
- مرحله ۱: عفونت HIV بدون علامت با تعداد سلولهای CD4 بیش از ۵۰۰ در هر میکرولیتر. ممکن است شامل بزرگ شدن گرههای لنفاوی نیز باشد.[۲۶]
- مرحله ۲: علائم خفیف که ممکن است تغییر جزئی غشاء مخاطی و عود عفونت دستگاه تنفسی فوقانی را شامل شود و تعداد سلولهای CD4 کمتر از ۵۰۰ در هر میکرولیتر است.[۲۶]
- مرحله ۳: علائم پیشرفته که ممکن است شامل اسهال مزمن و غیر عادی برای بیش از یک ماه شود، به همراه عفونتهای باکتریایی شدید از جمله سل ریوی و همچنین تعداد سلولهای CD4 کمتر از ۳۵۰ در هر میکرولیتر.[۲۶]
- مرحله ۴ یا ایدز: علائم شدیدی شامل توکسوپلاسموز مغز، کاندیدیاز مری، نای، نایژه یا شش و سارکوم کاپوزی. تعداد سلولهای CD4 به کمتر از ۲۰۰ در هر میکرولیتر میرسد.[۲۶]
مرکز کنترل و پیشگیری بیماری آمریکا نیز ایجاد یک سیستم طبقهبندی برای HIV ارائه نموده و آخرین بار آن را در سال ۲۰۰۸ به روز رسانی کردهاست.[۸۶] در این سیستم عفونت HIV بر اساس شمارش CD4 و علائم بالینی میباشد،[۸۶] عفونت را در سه مرحله توصیف میکند:
- مرحله ۱: تعداد سلولهای CD4 بیشتر از ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۲: تعداد سلولهای CD4 بین ۲۰۰ تا ۵۰۰ در هر میکرولیتر بدون هیچ علائمی از ایدز
- مرحله ۳: تعداد سلولهای CD4 کمتر از ۵۰۰ در هر میکرولیتر یا وجود علائمی از ایدز
- نامعلوم: اگر اطلاعات کافی برای هر یک از مراحل فوق در دسترس باشد
اگر پس از درمان، تعداد سلولهای CD4 خون به بیش از ۲۰۰ در هر میکرولیتر افزایش یابد و یا بیماری دیگری به جز ایدز احتمال رود و یا حتی درمان گردد هنوز هم تشخیص اینکه بیماری ایدز بوده باشد پابرجا خواهد بود.[۲۴]
پیشگیری [ویرایش]
تماس جنسی [ویرایش]
استفاده همیشگی از کاندوم در طولانی مدت، حدوداً ۸۰ درصد خطر انتقال HIV را کاهش میدهد.[۸۷] هنگامی که از بین زن و مرد، یکی از طرفین مبتلا شود، در صورتی که به طور مداوم از کاندوم استفاده شود، احتمال ابتلا به HIV برای فرد غیرآلوده در هر سال زیر ۱٪ است.[۸۸] برخی از شواهد نشان میدهد که کاندوم زنانه هم میتواند در همان سطح محافظت کند.[۸۹] به نظر میرسد استفاده از ژل واژینال حاوی تنوفوویر بلافاصله قبل از رابطه جنسی، میزان ابتلا را تا حدود ۴۰ درصد در میان زنان آفریقایی کاهش میدهد.[۹۰] در مقابل، استفاده از اسپرمکش نونوکسینول-۹، به دلیل ایجاد سوزش در واژن و رکتوم میتواند خطر انتقال را افزایش دهد.[۹۱] ختنه در آفریقای سیاه، خطر ابتلا به HIV توسط مردان دگرجنسگرا را بین ۳۸٪ و ۶۶٪ در بیش از ۲۴ ماه کاهش میدهد.[۹۲] بر پایه این مطالعات، سازمان جهانی بهداشت و UNAIDS، ختنه مرد را به عنوان یکی از روشهای پیشگیری انتقال HIV از زن به مرد در سال ۲۰۰۷ توصیه کردهاند.[۹۳] در این که آیا این کار باعث محافظت انتقال مرد به زن میشود، مناقشه است.[۹۴][۹۵] و این که آیا به نفع کشورهای توسعهیافته و در میان مردان همجنسگرا است، نامشخص است.[۹۶][۹۷][۹۸] زنانی که مورد ختنه قرار میگیرند، بیشتر در معرض خطر انتقال HIV قرار دارند. [۹۹]
برنامههایی که پرهیز جنسی را تشویق میکنند، به نظر نمیرسد که بتواند در مقابل خطر HIV موثر باشند.[۱۰۰] شواهد نشان میدهد که آموزش دوطرفه به همان اندازه ضعیف است.[۱۰۱] آموزش مسائل جنسی در مدارس میتواند رفتار پرخطر را کاهش دهد. [۱۰۲] اقلیت قابل توجهی از جوانان با اینکه نسبت به خطرات HIV و ایدز آگاه هستند، اما با این حال همچنان دست به کارهایی میزدند که پرخطر محسوب میشوند.[۱۰۳] مشخص نیست که آیا درمان سایر بیماری های مقاربتی در پیشگیری از HIV موثر باشد یا خیر.[۵۲]
پیش از در معرض قرار گرفتن [ویرایش]
درمان زودهنگام افراد مبتلا به HIV با ضدویروس، تا ۹۶ درصد از سرایت شریک آنها جلوگیری میکند.[۱۰۴][۱۰۵] پیشگیری پیش از در معرض قرارگرفتن با دوز معینی در روز از داروی تنوفوویر به همراه یا بدون امتریسیتابین بر روی بعضی از گروهها موثر است: مردانی که با مردان دیگر نزدیکی دارند، زوجهایی که یکی از آنها مبتلا به HIV است، و دگرجنسگراهای جوان در آفریقا.[۹۰]
به نظر میرسداقدامات احتیاطی جهانی در محیط مراقبتهای بهداشتی بر روی کاهش خطر HIV موثر است.[۱۰۶] اعتیاد به مواد مخدر تزریقی عامل مهم دیگری است و راهبردهای کاهش آسیبمانند برنامه تعویض سرنگ و درمان جایگزین مواد مخدر ظاهراً در کاهش خطر انتقال موثر بودهاند.[۱۰۷]
پس از در معرض قرار گرفتن [ویرایش]
پیشگیری پس از در معرض قرارگرفتن، دوره استفاده از ضدویروس است که در طول ۴۸ تا ۷۲ ساعت پس از در معرض قرار گرفتن خون یا ترشحات تناسلی آلوده به HIV تجویز شده باشد.[۱۰۸]استفاده از زیدوودین به تنهایی خطر ابتلا به عفونت HIV از طریق تزریق سرنگ را تا پنج برابر کاهش میدهد..[۱۰۸] این درمان بعد ازتجاوز جنسی و هنگامی که فرد متجاوز به عنوان مبتلا به HIV شناخته شده توصیه میشود، جای بحث دارد. اما در مواقعی که وضعیت HIV نامعلوم است، [۱۰۹] برنامههای درمانی فعلی معمولاً از لپیناویر/ریتوناویر و لمیودین/زیدوودین یا تنوفوویر/امتریسیتابینبرای درمان استفاده میکنند و میتواند خطر را به میزان بیشتری کاهش دهند.[۱۰۸] طول دوره درمان معمولاً چهار هفته است[۱۱۰] و اغلب با عوارض جانبی (در حدود ۷۰٪ از موارد زیدوودین که شامل ۲۴٪ تهوع، ۲۲٪ خستگی، ۱۳ درصد روان پریشی و ۹٪ سردرد میشود) همراه هستند.[۴۱]
مادر به فرزند [ویرایش]
برنامههای جلوگیری از انتقال HIV از مادر به فرزند می تواند سرعت انتقال را به اندازه ۹۲ تا ۹۹ درصد کاهش دهد.[۶۳][۱۰۷] این دوره اساساً شامل استفاده از داروهای ضدویروسی به صورت ترکیبی در دوره حاملگی و بعد از زایمان در بچه میشود و ترجیحاً باید به جای شیردهی از شیشه شیر استفاده شود.[۶۳][۱۱۱]اگر تغذیه جایگزین قابل قبول، امکانپذیر، مقرون به صرفه، پایدار و ایمن باشد، مادران باید از شیردهی به نوزادان خود خودداری کنند، با این حال در صورتی که موردی نباشد، شیر مادر در ماههای اول بسیار توصیه می شود.[۱۱۲] اگر تغذیه شیر فقط توسط مادر انجام شود، دوره پیشگیری طولانی مدت ضد ویروسی به نوزاد خطر انتقال را کاهش می دهد. [۱۱۳]
واکسیناسیون [ویرایش]
تاکنون (سال ۲۰۱۲) هیچ گونه واکسن موثری برای ایدز کشف نشده است.[۱۱۴] در واکسن آزمایشی RV 144 که در سال ۲۰۰۹ منتشر شد کاهش جزئی تقریباً ۳۰% در خطر انتقال مشاهده شد، که باعث ایجاد امیدی در جامعه تحقیقای برای برای یک واکسن موثر شد.[۱۱۵] آزمایشهای بیشتری بر روی واکسن RV 144 در حال انجام است.[۱۱۶][۱۱۷]
آگاهی عمومی از زندگی با اچآیوی [ویرایش]
ایدز تنها یک مشکل پزشکی نیست، بلکه یک مشکل اجتماعی و فرهنگی نیز هست، این بیماری تابو تلقی میشود و با هالهای از شرم و منعهای اخلاقی و فرهنگی همراهاست که این موضوع مانع از اعلام بیماری از سوی افراد شده و همین مساله منجر به پنهان ماندن بیماری، طی نشدن پروسه درمان و در نتیجه شیوع سریع آن میشود..[۱۱۸] به علت پیش داوری و ترس از سرایت بیماری، این بیماران درمورد انتخاب مسکن، شغل، مراقبتهای بهداشتی و حمایت عمومی مورد تبعیض قرار میگیرند. رفتارهای نامناسب و تحقیرآمیز موجب انزوای بیمار گشته، فرصت آموزش را از وی میگیرد. وحشت از مرگ، وحشت طرد و تنهایی و انگ اجتماعی، اخراج کارگران مبتلا و بدنامی از طرف دوستان و خانواده سبب میشود افرادی که گمان میکنند ممکن است دچار باشند، وضعیت خودشان را تا جایی که مقدور است مخفی نگه دارند که این خود موجب گسترش بیماری است[۱۱۸].
بسیاری از افرادی که با اچآیوی زندگی میکنند از بیماری خود ناآگاهند.[۱۱۹] کمتر از یک درصد از جمعیت شهری آفریقا که از نظر جنسی فعال هستند آزمونِ اچآیوی دادهاند و این نسبت در منطقههای روستایی از این هم کمتر است. همچنین تنها نیم درصد از زنان بارداری که از امکانات بهداشت شهری بهره میگیرند، آزمایشِ اچآیوی داده و نتیجهٔ آزمایش خود را دریافت نمودهاند. افزون بر آن، این نسبت برای بهداشت روستایی از این هم پایینتر است.[۱۱۹]
روز جهانی ایدز [ویرایش]
از سال ۱۹۸۸ به منظور افزایش بودجهها و همچنین افزایش آگاهی، آموزش و مبارزه با تبعیضها روز اول دسامبر هر سال به عنوان روز جهانی ایدز نامگذاری شد و هر ساله برای این روز، شعار خاصی نیز در نظر گرفته میشود، هدف عمده از این کار این است که به عموم مردم یادآوری شود که HIV از بین نرفتهاست و هنوز کارهای زیادی است که باید انجام شود.[۱۲۰]
در روز جهانی ایدز مردم لباسهایی مزین به روبان قرمز بر تن میکنند تا توجه و مراقبت در برابر HIV و ایدز را متذکر شده و به دیگران یادآور شوند که به تعهد و پایبندی و حمایت آنها مورد نیاز است.[۱۲۰]
انگ و بدنامی [ویرایش]
ایدز تنها یک مشکل بهداشتی نیست، بلکه یک مشکل اجتماعی و فرهنگی نیز هست، این بیماری تابو تلقی میشود و با هالهای از شرم و منعهای اخلاقی و فرهنگی همراهاست که این موضوع مانع از اعلام بیماری از سوی افراد شده و همین مساله منجر به پنهان ماندن بیماری، طی نشدن پروسه درمان و در نتیجه شیوع سریع آن میشود.[۱۱۸]
به علت پیش داوری و ترس از سرایت بیماری، این بیماران درمورد انتخاب مسکن، شغل، مراقبتهای بهداشتی و حمایت عمومی موردتبعیض قرار میگیرند. رفتارهای نامناسب و تحقیرآمیز موجب انزوای بیمار گشته، فرصت آموزش را از وی میگیرد. وحشت از مرگ، وحشت طرد و تنهایی و انگ اجتماعی، اخراج کارگران مبتلا و بدنامی از طرف دوستان و خانواده سبب میشود افرادی که گمان میکنند ممکن است دچار باشند، وضعیت خودشان را تا جایی که مقدور است مخفی نگه دارند که این خود موجب گسترش ابتلا است[۱۱۸].
ایدز در جهان [ویرایش]
ایدز در آفریقا [ویرایش]
ایدز در آفریقا، خاستگاه این بیماری، به صورت یک اپیدمی فراگیر درآمدهاست که رفته رفته به صورت مهمترین عامل جلوگیری از پاگیری اقتصادها و حکومتهای پایدار در این قاره جلوهگر میشود،۲۶ میلیون از بیش از ۴۰ میلیون انسان حامل ویروس اچآیوی آفریقائیاند و تا به حا ل بیش از ۲۵ میلیون نفر در این قاره جان خود را بدلیل ابتلای به آن از دست دادهاند. هرچند زندگی همراه با ویروساچآیوی ممکن است ولی در عمل، در کشورهای فقیر جهان تنها ۱/۶میلیون نفر به داروهای کنترل ایدز دست مییابند. عدم توانایی مالی برای تامین هزینههای سنگین این داروها برای عده بسیار زیادی از مبتلایان منجر به عدم آغاز پروسه درمان میگردد و مطابق آمار بیشتر کسانی که بر اثر کمبود پول از بیماری ایدز میمیرند، در آفریقا و در جنوب صحرا زندگی میکنند. بیشتر آنان زنان هستند که پس از مرگ، کودکانشان بیسرپرست میمانند.[۱۲۲]
ایدز در ایران [ویرایش]
راههای اصلی انتقال ایدز در ایران، آمیزش جنسی و استفادهٔ معتادان تزریقی از سرنگ مشترک است. اگر چه میزان مبتلایان به بیماری ایدز در ایران کم بودهاست،[۱۲۳] ولی به گفته سازمان بهداشت جهانی بر اساس دادههای گزارش شده، نرخ رشد اپیدمی ایدز در ایران به صورت هشدار دهندهای در حال افزایش است.[۱۲۴]
براساس آمار، تا پاییز سال ۱۳۹۰ حدود ۲۴ هزار نفر (در مجموع ۲۳٬۹۰۲ نفر) افراد مبتلا به ویروس اچآیوی (عامل بیماری ایدز) به طور رسمی در بانک اطلاعاتی وزارت بهداشت ثبت شدهاند. بنابراین با فرمول «تخمین موارد واقعی بر اساس موارد ثبت شده»، هم اکنون حدود ۸۰ هزار نفر اچآیوی مثبت در ایران وجود دارد. اما بر اساس آمار غیر رسمی، ۱۲۰ هزار ناقل اچآیوی در ایران وجود دارد. از میان افراد ثبت شده، ۹۱ درصد مرد و ۹ درصد زن هستند و حدود نیمی از مبتلایان در گروه سنی ۲۵ تا ۳۴ سال قرار دارند. براساس این گزارش در میان علل ابتلا به HIV، تزریق با وسایل مشترک در مصرف کنندگان مواد، رتبه نخست و ابتلا از طریق رابطه جنسی رتبه دوم را دارد. با این حال، به گفتهٔ دکتر مینو محرز رئیس مرکز تحقیقات ایدز وزارت بهداشت، «مهمترین مسئلهای که از این آمار میتوان استنباط کرد، افزایش شیوع جنسی بیماری ایدز است که در این آمار ۱۰٫۳ درصد ذکر شده که البته واقعیت موجود در مراکز درمانی بسیار بیش از این است.»[۱۲۵][۱۲۶] بیش از ۹۰ درصد زنان مبتلا بدون اینکه آگاه باشند، از طریق شوهرانشان مبتلا به اچآیوی میشوند.[۱۲۷] این بیماری در میان جوانان، زنان و همچنین کودکان کار در حال افزایش است.[۱۲۷][۱۲۸]
حرف زدن از بیماری ایدز در ایران با محدودیتهای اخلاقی و عرفی همراهاست. بحث و گفتگو درباره بلوغ، بهداشت جنسی و بیماریهای آمیزشی در خانوادهها محدود است. مبتلایان به ایدز همواره نگران واکنشهای جامعه بودهاند. ابراز ابتلا به این بیماری موجب «انگ اخلاقی» و طرد بیمار از خانواده، اطرافیان و جامعه میشود. این امر باعث پنهانکاری و مخفی کردن بیماری میگردد، بنابراین ایدز در خفا گسترش مییابد و کنترل بیماری را دشوار میکند.[۱۲۵][۱۲۷]
نخستین مورد گزارش و ثبت شدهٔ ابتلا به ایدز در ایران مربوط به سال ۱۳۶۶ و در مورد یک کودک شش ساله مبتلا به بیماری هموفیلی است که فرآوردههای خونی آلوده دریافت کرده بود. که از فرانسه به ایران منتقل شده بود. در سالهای اولیهٔ شیوع بیماری، وجود ایدز در ایران اساسا انکار میشد. در ارتباط با این بیماری دو پروندهٔ قضایی عمده وجود دارد. پروندهٔ برادران علایی پزشکانی که برای فعالیتهایشان در زمینه شناساندن و مبارزه با بیماری ایدز در ایران شهرت بین المللی دارند و به اتهام مخالفت با حکومت در سال ۱۳۸۷ بازداشت و حبس شدند که اعتراضات گستردهٔ بینالمللی را در پی داشت.[۱۲۹]
پانویس [ویرایش]
- ↑ Sepkowitz KA. “AIDS—the first 20 years”. N. Engl. J. Med. 344, no. 23 (June 2001): 1764–72.doi:10.1056/NEJM200106073442306.PMID 11396444.
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ ۲٫۳ ۲٫۴ ۲٫۵ ۲٫۶ ۲٫۷ ۲٫۸ ۲٫۹ Markowitz, edited by William N. Rom ; associate editor, Steven B..Environmental and occupational medicine. 4th ed. Wolters Kluwer/Lippincott Williams & Wilkins, 2007. 745.ISBN 978-0-7817-6299-1.
- ↑ “HIV and Its Transmission”. Centers for Disease Control and Prevention, 2003. Archived from the original on February 4, 2005.
- ↑ Sharp, PM and Hahn, BH. “Origins of HIV and the AIDS Pandemic”. Cold Spring Harbor perspectives in medicine 1, no. 1 (2011 Sep): a006841.doi:10.1101/cshperspect.a006841. PMC 3234451.PMID 22229120.
- ↑ Gallo RC. “A reflection on HIV/AIDS research after 25 years”. Retrovirology 3 (2006): 72. doi:10.1186/1742-4690-3-72. PMC 1629027. PMID 17054781.
- ↑ “Global Report Fact Sheet”. UNAIDS. 2010.
- ↑ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامUN2011Tenوارد نشدهاست. - ↑ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامKallingsوارد نشدهاست. - ↑ Gottlieb MS. “Pneumocystis pneumonia—Los Angeles. 1981”. Am J Public Health 96, no. 6 (2006): 980–1; discussion 982–3. doi:10.2105/AJPH.96.6.980.PMC 1470612. PMID 16714472. Archived from the original on April 22, 2009.
- ↑ Friedman-Kien AE. “Disseminated Kaposi's sarcoma syndrome in young homosexual men”. J. Am. Acad. Dermatol. 5, no. 4 (October 1981): 468–71.doi:10.1016/S0190-9622(81)80010-2.PMID 7287964.
- ↑ Basavapathruni, A and KS Anderson. “Reverse transcription of the HIV-1 pandemic”. The FASEB Journal, no. 14 (December فصل=21 2007): 3795–3808.doi:10.1096/fj.07-8697rev. PMID 17639073.
- ↑ Sharp, PM. ۱. “Origins of HIV and the AIDS Pandemic”.Cold Spring Harbor perspectives in medicine, no. 1 (2011 Sep): a006841. doi:10.1101/cshperspect.a006841.PMC 3234451. PMID 22229120.
- ↑ Gao F. ۳۹۷. “Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes”. Nature, no. 6718 (February 1999): 436–41. doi:۱۰٫۱۰۳۸/۱۷۱۳۰. PMID 9989410.
- ↑ ۱۴٫۰ ۱۴٫۱ Reeves, J. D. and Doms, R. W. ۸۳. “Human Immunodeficiency Virus Type 2”. J. Gen. Virol., no. Pt 6 (2002): 1253–65. doi:10.1099/vir.0.18253-0.PMID 12029140.
- ↑ Goodier, J. , and Kazazian, H.. ۱۳۵. “Retrotransposons Revisited: The Restraint and Rehabilitation of Parasites”.Cell, no. 1 (2008): 23–35.doi:10.1016/j.cell.2008.09.022.PMID 18854152.(subscription required)
- ↑ Kalish ML. ۱۱. “Central African hunters exposed to simian immunodeficiency virus”. Emerg Infect Dis, no. 12, 1928–30. doi:10.3201/eid1112.050394. PMID 16485481.
- ↑ Marx PA, Alcabes PG, Drucker E. ۳۵۶. “Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa”. Philos Trans R Soc Lond B Biol Sci, no. 1410 (2001): 911–20.doi:10.1098/rstb.2001.0867. PMC 1088484.PMID 11405938.
- ↑ Zhu, T. , Korber, B. T. , Nahmias, A. J. , Hooper, E. , Sharp, P. M. and Ho, D. D.. ۳۹۱. “An African HIV-1 Sequence from 1959 and Implications for the Origin of the epidemic”. Nature, no. 6667 (1998): 594–7.doi:۱۰٫۱۰۳۸/۳۵۴۰۰. PMID 9468138.
- ↑ KOLATA, GINA. “BOY'S 1969 DEATH SUGGESTS AIDS INVADED U.S. SEVERAL TIMES”. NY Times. NY Times, October 28 1987 (Released on October 28, 1987). Retrieved ۲۰۱۳/۰۱/۱۴.
- ↑ ۲۰٫۰ ۲۰٫۱ Gilbert, M. Thomas P.. ۱۰۴. “The emergence of HIV/AIDS in the Americas and beyond”.PNAS, no. 47 (November 20 2007): 18566–18570.doi:10.1073/pnas.0705329104. PMC 2141817.PMID 17978186.
- ↑ Centers for Disease Control (CDC). ۳۱. “Persistent, generalized lymphadenopathy among homosexual males”.MMWR Morb Mortal Wkly Rep., no. 19 (1982): 249–251.PMID 6808340.
- ↑ Centers for Disease Control (CDC). ۳۱. “Opportunistic infections and Kaposi's sarcoma among Haitians in the United States”. MMWR Morb Mortal Wkly Rep., no. 26 (1982): 353–354; 360–361. PMID 6811853.
- ↑ ۲۳٫۰ ۲۳٫۱ ۲۳٫۲ «ایدز: صفر تا صد». بیبیسی. بیبیسی، ۲۹ نوامبر ۲۰۱۲. بازبینیشده در ۱۴ ژانویه ۲۰۱۳.
- ↑ ۲۴٫۰ ۲۴٫۱ ۲۴٫۲ ۲۴٫۳ ۲۴٫۴ Mandell, Bennett, and Dolan (2010). Chapter 121.
- ↑ ۲۵٫۰ ۲۵٫۱ ۲۵٫۲ “Stages of HIV”. U.S. Department of Health & Human Services. Dec 2010.
- ↑ ۲۶٫۰۰ ۲۶٫۰۱ ۲۶٫۰۲ ۲۶٫۰۳ ۲۶٫۰۴ ۲۶٫۰۵ ۲۶٫۰۶ ۲۶٫۰۷ ۲۶٫۰۸۲۶٫۰۹ ۲۶٫۱۰ ۲۶٫۱۱ ۲۶٫۱۲ ۲۶٫۱۳ ۲۶٫۱۴ WHO case definitions of HIV for surveillance and revised clinical staging and immunological classification of HIV-related disease in adults and children.. World Health Organization, 2007. 6–16.ISBN 978-92-4-159562-9.
- ↑ Diseases and disorders.. Tarrytown, NY: Marshall Cavendish, 2008. 25. ISBN 978-0-7614-7771-6.
- ↑ ۲۸٫۰۰ ۲۸٫۰۱ ۲۸٫۰۲ ۲۸٫۰۳ ۲۸٫۰۴ ۲۸٫۰۵ ۲۸٫۰۶ ۲۸٫۰۷ ۲۸٫۰۸۲۸٫۰۹ ۲۸٫۱۰ ۲۸٫۱۱ Mandell, Bennett, and Dolan (2010). Chapter 118.
- ↑ ۲۹٫۰ ۲۹٫۱ ۲۹٫۲ ۲۹٫۳ Vogel, M. ۱۰۷. “The treatment of patients with HIV”. Deutsches Ärzteblatt international, 2010 Jul, 507–15. doi:10.3238/arztebl.2010.0507.PMC 2915483. PMID 20703338.
- ↑ Evian, Clive. Primary HIV/AIDS care: a practical guide for primary health care personnel in a clinical and supportive setting. Updated 4th ed. Houghton [South Africa]: Jacana, 2006. 29. ISBN 978-1-77009-198-6.
- ↑ Radiology of AIDS. Berlin [u.a.]: Springer, 2001. 19.ISBN 978-3-540-66510-6.
- ↑ Elliott, Tom. Lecture Notes: Medical Microbiology and Infection. John Wiley & Sons, 2012. 273. ISBN 978-1-118-37226-5.
- ↑ ۳۳٫۰ ۳۳٫۱ Blankson, JN. “Control of HIV-1 replication in elite suppressors”. Discovery medicine 9, no. 46 (2010 Mar): 261–6. PMID 20350494.
- ↑ Holmes CB, Losina E, Walensky RP, Yazdanpanah Y, Freedberg KA. “Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa”. Clin. Infect. Dis. 36, no. 5 (2003): 656–662.doi:10.1086/367655. PMID 12594648.
- ↑ Chu, C and Selwyn, PA. “Complications of HIV infection: a systems-based approach”. American family physician 83, no. 4 (2011-02-15): 395–406. PMID 21322514.
- ↑ ۳۶٫۰ ۳۶٫۱ ۳۶٫۲ Mandell, Bennett, and Dolan (2010). Chapter 169.
- ↑ “AIDS”. MedlinePlus. A.D.A.M..
- ↑ Sestak K. “Chronic diarrhea and AIDS: insights into studies with non-human primates”. Curr. HIV Res. 3, no. 3 (July 2005): 199–205.doi:10.2174/1570162054368084. PMID 16022653.
- ↑ ۳۹٫۰ ۳۹٫۱ Smith, DK. 54. “Antiretroviral postexposure prophylaxis after sexual, injection-drug use, or other nonoccupational exposure to HIV in the United States: recommendations from the U.S. Department of Health and Human Services.”. MMWR. Recommendations and reports: Morbidity and mortality weekly report. Recommendations and reports / Centers for Disease Control, no. RR-2 (2005 Jan 21). PMID 15660015.
- ↑ Coovadia H. 351. “Antiretroviral agents—how best to protect infants from HIV and save their mothers from AIDS”. N. Engl. J. Med., no. 3 (2004): 289–292.doi:10.1056/NEJMe048128. PMID 15247337.
- ↑ ۴۱٫۰ ۴۱٫۱ ۴۱٫۲ ۴۱٫۳ Kripke, C. 76. “Antiretroviral prophylaxis for occupational exposure to HIV.”. American family physician, no. 3 (2007 Aug 1). PMID 17708137.
- ↑ ۴۲٫۰ ۴۲٫۱ ۴۲٫۲ ۴۲٫۳ Dosekun, O. 5. “An overview of the relative risks of different sexual behaviours on HIV transmission.”. Current opinion in HIV and AIDS, no. 4 (2010 Jul). doi:10.1097/COH.0b013e32833a88a3.PMID 20543603.
- ↑ Cunha, Burke. Antibiotic Essentials 2012. 11 ed. 2012. 303. ISBN 9781449693831.
- ↑ ۴۴٫۰ ۴۴٫۱ Boily, MC. 9. “Heterosexual risk of HIV-1 infection per sexual act: systematic review and meta-analysis of observational studies.”. The Lancet infectious diseases, no. 2 (2009 Feb): 118-29.doi:10.1016/S1473-3099(09)70021-0.PMID 19179227.
- ↑ Baggaley, RF. 37. “Systematic review of orogenital HIV-1 transmission probabilities.”. International Journal of Epidemiology, no. 6 (2008 Dec): 1255-65.doi:10.1093/ije/dyn151. PMC 2638872.PMID 18664564.
- ↑ ۴۶٫۰ ۴۶٫۱ “HIV in the United States: An Overview”.Center for Disease Control and Prevention. March 2012.
- ↑ ۴۷٫۰ ۴۷٫۱ ۴۷٫۲ ۴۷٫۳ ۴۷٫۴ ۴۷٫۵ ۴۷٫۶ Boily MC, Baggaley RF, Wang L, Masse B, White RG, Hayes RJ, Alary M. ۹. “Heterosexual risk of HIV-1 infection per sexual act: systematic review and meta-analysis of observational studies”. The Lancet Infectious Diseases, no. 2 (February 2009): 118–129. doi:10.1016/S1473-3099(09)70021-0. PMID 19179227.
- ↑ Yu, M. ۱۰. “Mucosal HIV transmission and vaccination strategies through oral compared with vaginal and rectal routes”. Expert opinion on biological therapy, no. 8 (2010 Aug): 1181–95. doi:۱۰٫۱۵۱۷/۱۴۷۱۲۵۹۸٫۲۰۱۰٫۴۹۶۷۷۶.PMC 2904634. PMID 20624114.
- ↑ Stürchler، Dieter A.. Exposure a guide to sources of infections. ASM Press، ۲۰۰۶. ۵۴۴. شابک ۹۷۸۱۵۵۵۸۱۳۷۶۵.
- ↑ al.], edited by Richard Pattman... [et. Oxford handbook of genitourinary medicine, HIV, and sexual health. Oxford University Press, 2010. 95.ISBN 9780199571666.
- ↑ ۵۱٫۰ ۵۱٫۱ ۵۱٫۲ Dosekun، O. ۵. «An overview of the relative risks of different sexual behaviours on HIV transmission». Current opinion in HIV and AIDS، ش. ۴ (2010 Jul): ۲۹۱–۷.doi:10.1097/COH.0b013e32833a88a3.PMID ۲۰۵۴۳۶۰۳.
- ↑ ۵۲٫۰ ۵۲٫۱ Ng, BE. “Population-based biomedical sexually transmitted infection control interventions for reducing HIV infection”. Cochrane database of systematic reviews (Online), no. 3 (2011-03-16): CD001220.doi:10.1002/14651858.CD001220.pub3.PMID 21412869.
- ↑ Anderson, J. ۲۵. “Women and HIV: motherhood and more”. Current opinion in infectious diseases, no. 1 (2012 Feb): 58–65. doi:10.1097/QCO.0b013e32834ef514.PMID 22156896.
- ↑ Klimas, N. ۷۰. “Overview of HIV”. Psychosomatic Medicine, no. 5 (2008 Jun): 523–30.doi:10.1097/PSY.0b013e31817ae69f.PMID 18541903.
- ↑ Draughon, JE. ۱۷. “Nonoccupational post exposure prophylaxis following sexual assault in industrialized low-HIV-prevalence countries: a review”. Psychology, health & medicine, no. 2 (2012): 235–54.doi:۱۰٫۱۰۸۰/۱۳۵۴۸۵۰۶٫۲۰۱۱٫۵۷۹۹۸۴.PMID 22372741.
- ↑ ۵۶٫۰ ۵۶٫۱ Baggaley, RF. ۶. “Risk of HIV-1 transmission for parenteral exposure and blood transfusion: a systematic review and meta-analysis”. AIDS (London, England), 2006-04-04, 805–12.doi:10.1097/01.aids.0000218543.46963.6d.PMID 16549963.
- ↑ “Will I need a blood transfusion?”. NHS patient information. National Health Services, 2011.
- ↑ UNAIDS 2011 pg. 60–70
- ↑ “Blood safety ... for too few”. سازمان بهداشت جهانی, 2001.
- ↑ ۶۰٫۰ ۶۰٫۱ Reid, SR. ۶. “Injection drug use, unsafe medical injections, and HIV in Africa: a systematic review”.Harm reduction journal, 2009-08-28, 24.doi:۱۰٫۱۱۸۶/۱۴۷۷-۷۵۱۷-۶-۲۴. PMC 2741434.PMID 19715601.
- ↑ ۶۱٫۰ ۶۱٫۱ “Basic Information about HIV and AIDS”.Center for Disease Control and Prevention. April 2012.
- ↑ «Why Mosquitoes Cannot Transmit AIDS [HIV virus»] (en). Rci.rutgers.edu، ۲۰۱۰-۰۷-۲۸.
- ↑ ۶۳٫۰ ۶۳٫۱ ۶۳٫۲ ۶۳٫۳ ۶۳٫۴ ۶۳٫۵ Coutsoudis, A and Kwaan, L; Thomson, M. “Prevention of vertical transmission of HIV-1 in resource-limited settings”. Expert review of anti-infective therapy 8, no. 10 (2010 Oct): 1163–75.doi:10.1586/eri.10.94. PMID 20954881.
- ↑ «Fluids of transmission». AIDS.gov. United States Department of Health and Human Services، 1 November 2011.
- ↑ ۶۵٫۰ ۶۵٫۱ Thorne, C. ۱۲. “HIV”. Seminars in fetal & neonatal medicine, no. 3 (2007 Jun): 174–81.doi:10.1016/j.siny.2007.01.009. PMID 17321814.
- ↑ Alimonti JB, Ball TB, Fowke KR. “Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS”. J. Gen. Virol. 84, no. 7 (2003): 1649–1661. doi:10.1099/vir.0.19110-0.PMID 12810858.
- ↑ International Committee on Taxonomy of Viruses.“61.0.6. Lentivirus”. National Institutes of Health, 2002. Archived from the original on 2006-04-18.
- ↑ International Committee on Taxonomy of Viruses.“61. Retroviridae”. National Institutes of Health, 2002. Archived from the original on 2006-06-29.
- ↑ Lévy, J. A.. “HIV pathogenesis and long-term survival”.AIDS 7, no. 11 (1993): 1401–10.doi:10.1097/00002030-199311000-00001.PMID 8280406.
- ↑ Smith, Johanna A.; Daniel, René (Division of Infectious Diseases, Center for Human Virology, Thomas Jefferson University, Philadelphia). “Following the path of the virus: the exploitation of host DNA repair mechanisms by retroviruses”. ACS Chem Biol 1, no. 4 (2006): 217–26.doi:10.1021/cb600131q. PMID 17163676.
- ↑ Martínez, edited by Miguel Angel. RNA interference and viruses : current innovations and future trends. Norfolk: Caister Academic Press, 2010. 73.ISBN 9781904455561.
- ↑ Immunology, infection, and immunity. Washington, D.C.: ASM Press, 2004. 550. ISBN 9781555812461.
- ↑ Gilbert, PB. “Comparison of HIV-1 and HIV-2 infectivity from a prospective cohort study in Senegal”. Statistics in Medicine 22, no. 4 (28 February 2003): 573–593.doi:10.1002/sim.1342. PMID 12590415.
- ↑ Piatak, M., Jr, Saag, M. S., Yang, L. C., Clark, S. J., Kappes, J. C., Luk, K. C., Hahn, B. H., Shaw, G. M. and Lifson, J.D.. “High levels of HIV-1 in plasma during all stages of infection determined by competitive PCR”.Science 259, no. 5102 (1993): 1749–1754.Bibcode: 1993Sci...259.1749P.doi:10.1126/science.8096089. PMID 8096089.
- ↑ Pantaleo G, Demarest JF, Schacker T, Vaccarezza M, Cohen OJ, Daucher M, Graziosi C, Schnittman SS, Quinn TC, Shaw GM, Perrin L, Tambussi G, Lazzarin A, Sekaly RP, Soudeyns H, Corey L, Fauci AS.. “The qualitative nature of the primary immune response to HIV infection is a prognosticator of disease progression independent of the initial level of plasma viremia”. Proc Natl Acad Sci U S A.94, no. 1 (1997): 254–258.Bibcode: 1997PNAS...94..254P.doi:10.1073/pnas.94.1.254. PMC 19306.PMID 8990195.
- ↑ Guss DA. “The acquired immune deficiency syndrome: an overview for the emergency physician, Part 1”. J Emerg Med 12, no. 3 (1994): 375–84.doi:10.1016/0736-4679(94)90281-X. PMID 8040596.
- ↑ Hel Z, McGhee JR, Mestecky J. “HIV infection: first battle decides the war”. Trends Immunol. 27, no. 6 (June 2006): 274–81. doi:10.1016/j.it.2006.04.007.PMID 16679064.
- ↑ Arie J. Zuckerman et al. (eds). Principles and practice of clinical virology. 6th ed. Hoboken, N.J.: Wiley, 2007. 905. ISBN 978-0-470-51799-4.
- ↑ Mehandru S, Poles MA, Tenner-Racz K, Horowitz A, Hurley A, Hogan C, Boden D, Racz P, Markowitz M. “Primary HIV-1 infection is associated with preferential depletion of CD4+ T cells from effector sites in the gastrointestinal tract”. J. Exp. Med. 200, no. 6 (September 2004): 761–70.doi:10.1084/jem.20041196. PMC 2211967.PMID 15365095.
- ↑ Brenchley JM, Schacker TW, Ruff LE, Price DA, Taylor JH, Beilman GJ, Nguyen PL, Khoruts A, Larson M, Haase AT, Douek DC. “CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract”. J. Exp. Med. 200, no. 6 (September 2004): 749–59. doi:10.1084/jem.20040874. PMC 2211962.PMID 15365096.
- ↑ ۸۱٫۰ ۸۱٫۱ editor, Julio Aliberti,. Control of Innate and Adaptive Immune Responses During Infectious Diseases.. New York, NY: Springer Verlag, 2011. 145. ISBN 978-1-4614-0483-5.
- ↑ Appay V, Sauce D. “Immune activation and inflammation in HIV-1 infection: causes and consequences”. J. Pathol.214, no. 2 (January 2008): 231–41.doi:10.1002/path.2276. PMID 18161758.
- ↑ Brenchley JM, Price DA, Schacker TW, Asher TE, Silvestri G, Rao S, Kazzaz Z, Bornstein E, Lambotte O, Altmann D, Blazar BR, Rodriguez B, Teixeira-Johnson L, Landay A, Martin JN, Hecht FM, Picker LJ, Lederman MM, Deeks SG, Douek DC. “Microbial translocation is a cause of systemic immune activation in chronic HIV infection”. Nat. Med. 12, no. 12 (December 2006): 1365–71.doi:10.1038/nm1511. PMID 17115046.
- ↑ ۸۴٫۰ ۸۴٫۱ Kellerman, S. ۷. “HIV testing for children in resource-limited settings: what are we waiting for?”. PLoS medicine, no. 7 (2010 Jul 20): e1000285.doi:10.1371/journal.pmed.1000285. PMC 2907270.PMID 20652012.
- ↑ ۸۵٫۰ ۸۵٫۱ ۸۵٫۲ UNAIDS 2011 pg. 70–80
- ↑ ۸۶٫۰ ۸۶٫۱ ۸۶٫۲ ۸۶٫۳ Schneider, E. ۵۷. “Revised surveillance case definitions for HIV infection among adults, adolescents, and children aged <18 months and for HIV infection and AIDS among children aged 18 months to <13 years--United States, 2008”. MMWR. Recommendations and reports: Morbidity and mortality weekly report. Recommendations and reports / Centers for Disease Control, no. RR–10 (2008-12-05): 1–12.PMID 19052530.
- ↑ Crosby, R and Bounse, S. “Condom effectiveness: where are we now?”. Sexual health 9, no. 1 (2012 Mar): 10–7.doi:10.1071/SH11036. PMID 22348628.
- ↑ “Condom Facts and Figures”. WHO, August 2003.
- ↑ Gallo, MF and Kilbourne-Brook, M; Coffey, PS. “A review of the effectiveness and acceptability of the female condom for dual protection”. Sexual health 9, no. 1 (2012 Mar): 18–26. doi:10.1071/SH11037.PMID 22348629.
- ↑ ۹۰٫۰ ۹۰٫۱ Celum, C and Baeten, JM. “Tenofovir-based pre-exposure prophylaxis for HIV prevention: evolving evidence”. Current opinion in infectious diseases 25, no. 1 (2012 Feb): 51–7.doi:10.1097/QCO.0b013e32834ef5ef. PMC 3266126.PMID 22156901.
- ↑ Baptista, M and Ramalho-Santos, J. “Spermicides, microbicides and antiviral agents: recent advances in the development of novel multi-functional compounds”. Mini reviews in medicinal chemistry 9, no. 13 (2009-11-01): 1556–67. doi:10.2174/138955709790361548.PMID 20205637.
- ↑ Siegfried, N and Muller, M; Deeks, JJ; Volmink, J. Nandi Siegfried. ed. “Male circumcision for prevention of heterosexual acquisition of HIV in men”. Cochrane database of systematic reviews (Online), no. 2 (2009-04-15): CD003362.doi:10.1002/14651858.CD003362.pub2.PMID 19370585.
- ↑ “WHO and UNAIDS announce recommendations from expert consultation on male circumcision for HIV prevention”. World Health Organization, Mar 28 2007.
- ↑ Larke, N. “Male circumcision, HIV and sexually transmitted infections: a review”. British journal of nursing (Mark Allen Publishing) 19, no. 10 (2010 May 27 – Jun 9): 629–34. PMID 20622758.
- ↑ Eaton, L and Kalichman, SC. “Behavioral aspects of male circumcision for the prevention of HIV infection”. Current HIV/AIDS reports 6, no. 4 (2009 Nov): 187–93.doi:10.1007/s11904-009-0025-9.PMID 19849961.(subscription required)
- ↑ Kim, HH and Li, PS, Goldstein, M. “Male circumcision: Africa and beyond?”. Current opinion in urology 20, no. 6 (2010 Nov): 515–9.doi:10.1097/MOU.0b013e32833f1b21.PMID 20844437.
- ↑ Templeton, DJ and Millett, GA, Grulich, AE. “Male circumcision to reduce the risk of HIV and sexually transmitted infections among men who have sex with men”. Current opinion in infectious diseases 23, no. 1 (2010 Feb): 45–52.doi:10.1097/QCO.0b013e328334e54d.PMID 19935420.
- ↑ Wiysonge, CS. and EJ. Kongnyuy. “Male circumcision for prevention of homosexual acquisition of HIV in men”.Cochrane Database Syst Rev, no. 6 (2011): CD007496.doi:10.1002/14651858.CD007496.pub2.PMID 21678366.
- ↑ Utz-Billing I, Kentenich H. “Female genital mutilation: an injury, physical and mental harm”. J Psychosom Obstet Gynaecol 29, no. 4 (December 2008): 225–9.doi:10.1080/01674820802547087. PMID 19065392.
- ↑ Underhill K, Operario D, Montgomery P. Don Operario. ed. “Abstinence-only programs for HIV infection prevention in high-income countries”. Cochrane Database of Systematic Reviews, no. 4 (2008): CD005421.doi:10.1002/14651858.CD005421.pub2.PMID 17943855.
- ↑ Tolli, MV. “Effectiveness of peer education interventions for HIV prevention, adolescent pregnancy prevention and sexual health promotion for young people: a systematic review of European studies”. Health education research, 2012-05-28. doi:10.1093/her/cys055.PMID 22641791.
- ↑ Ljubojević, S and Lipozenčić, J. “Sexually transmitted infections and adolescence”. Acta dermatovenerologica Croatica : ADC 18, no. 4 (2010): 305–10.PMID 21251451.
- ↑ Patel VL, Yoskowitz NA, Kaufman DR, Shortliffe EH. “Discerning patterns of human immunodeficiency virus risk in healthy young adults”. Am J Med 121, no. 4 (2008): 758–764. doi:10.1016/j.amjmed.2008.04.022.PMC 2597652. PMID 18724961.
- ↑ National Institute of Allergy and Infectious Diseases (NIAID), "Treating HIV-infected People with Antiretrovirals Protects Partners from Infection", NIH News, 2011 May
- ↑ Anglemyer, A and Rutherford, GW; Baggaley, RC; Egger, M; Siegfried, N. George W Rutherford. ed. “Antiretroviral therapy for prevention of HIV transmission in HIV-discordant couples”. Cochrane database of systematic reviews (Online), no. 8 (2011-08-10): CD009153.doi:10.1002/14651858.CD009153.pub2.PMID 21833973.
- ↑ “Recommendations for prevention of HIV transmission in health-care settings”. MMWR 36, no. Suppl 2 (August 1987): 1S–18S. PMID 3112554.
- ↑ ۱۰۷٫۰ ۱۰۷٫۱ Kurth, AE and Celum, C; Baeten, JM; Vermund, SH; Wasserheit, JN. “Combination HIV prevention: significance, challenges, and opportunities”.Current HIV/AIDS reports 8, no. 1 (2011 Mar): 62–72.doi:10.1007/s11904-010-0063-3. PMC 3036787.PMID 20941553.
- ↑ ۱۰۸٫۰ ۱۰۸٫۱ ۱۰۸٫۲ “HIV exposure through contact with body fluids”. Prescrire Int 21, no. 126 (April 2012): 100–1 103–5. PMID 22515138.
- ↑ Linden, JA. “Clinical practice. Care of the adult patient after sexual assault”. The New England Journal of Medicine 365, no. 9 (2011-09-01): 834–41.doi:10.1056/NEJMcp1102869. PMID 21879901.
- ↑ Young, TN and Arens, FJ; Kennedy, GE; Laurie, JW; Rutherford, G. Taryn Young. ed. “Antiretroviral post-exposure prophylaxis (PEP) for occupational HIV exposure”. Cochrane database of systematic reviews (Online), no. 1 (2007-01-24): CD002835.doi:10.1002/14651858.CD002835.pub3.PMID 17253483.
- ↑ Siegfried, N and van der Merwe, L; Brocklehurst, P; Sint, TT. Nandi Siegfried. ed. “Antiretrovirals for reducing the risk of mother-to-child transmission of HIV infection”.Cochrane database of systematic reviews (Online), no. 7 (2011-07-06): CD003510.doi:10.1002/14651858.CD003510.pub3.PMID 21735394.
- ↑ “WHO HIV and Infant Feeding Technical Consultation Held on behalf of the Inter-agency Task Team (IATT) on Prevention of HIV – Infections in Pregnant Women, Mothers and their Infants –Consensus statement” (PDF). October 25–27 2006. Archived from the original on April 9, 2008.
- ↑ Horvath, T and Madi, BC; Iuppa, IM; Kennedy, GE; Rutherford, G; Read, JS. Tara Horvath. ed. “Interventions for preventing late postnatal mother-to-child transmission of HIV”. Cochrane database of systematic reviews (Online), no. 1 (2009-01-21): CD006734.doi:10.1002/14651858.CD006734.pub2.PMID 19160297.
- ↑ UNAIDS. «The quest for an HIV vaccine» (en). May 18, 2012.
- ↑ Reynell, L and Trkola, A. “HIV vaccines: an attainable goal?”. Swiss medical weekly 142 (2012-03-02): w13535.doi:10.4414/smw.2012.13535. PMID 22389197.
- ↑ U.S. Army Office of the Surgeon General. “HIV Vaccine Trial in Thai Adults”. ClinicalTrials.gov, March 21 2011.
- ↑ U.S. Army Office of the Surgeon General. “Follow up of Thai Adult Volunteers With Breakthrough HIV Infection After Participation in a Preventive HIV Vaccine Trial”. ClinicalTrials.gov, June 2 2010.
- ↑ ۱۱۸٫۰ ۱۱۸٫۱ ۱۱۸٫۲ ۱۱۸٫۳ «وبگاه ستاد مبارزه با مواد مخدر (روزنامه همشهری صفحه اجتماعی ۱۰-۹-۸۴)». بازبینیشده در ۱۵ اوت ۲۰۰۷.
- ↑ ۱۱۹٫۰ ۱۱۹٫۱Kumaranayake, L. and Watts, C.. Resource allocation and priority setting of HIV/AIDS interventions: addressing the generalized epidemic in sub-Saharan Africa. . J. Int. Dev.۱۳، ش. ۴ (۲۰۰۱): ۴۵۱–۴۶۶. نشانگر دیجیتالی شی:۱۰٫۱۰۰۲/jid.۷۹۸.
- ↑ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامiran_hiv_1وارد نشدهاست. - ↑ مصایب مضاعف زنبودن، وقتی اچآیوی مثبتباشی، بیبیسی فارسی
- ↑ روز جهانی ایدز | جامعه / حقوق | Deutsche Welle | ۰۱٫۱۲٫۲۰۰۷
- ↑ Ruxin, Josh. Agnes Binagwaho, Paul A. Wilson, UN Millennium Project Working Group on HIV/AIDS.Combating AIDS in the Developing World. Jeffrey D. Sachs, Josh Ruxin, Agnes Binagwaho. Earthscan, 2005. 69. ISBN 1-84407-225-8, 9781844072255.
- ↑ Gheissari, Ali. Contemporary Iran Economy, Society, Politics. Oxford University Press, 2009. 157. ISBN 0-19-537848-2, 9780195378481.
- ↑ ۱۲۵٫۰ ۱۲۵٫۱ «آمار غیر رسمی از وجود ۱۲۰ هزار ناقل HIV در کشور خبر میدهد». سلامت نیوز، ۱۷ خرداد ۱۳۹۱. بازبینیشده در ۲۰ خرداد ۱۳۹۱.
- ↑ «آخرین آمار مبتلایان به ایدز در ایران». رادیو زمانه. بازبینیشده در ۲ فوریه ۲۰۰۹.
- ↑ ۱۲۷٫۰ ۱۲۷٫۱ ۱۲۷٫۲ Arash Alaei, Kamiar Alaei in Health: HIV and AIDS. , Encyclopedia of Women & Islamic Cultures. General Editor: Suad Joseph. Brill
- ↑ ««هپاتیت» و «ایدز» در یک قدمی کودکان زباله جمعکن». سلامت نیوز، ۱۷خرداد۱۳۹۱. بازبینیشده در ۲۰ خرداد ۱۳۹۱.
- ↑ «آرش علایی آزاد شد». بیبیسی، ۲۹ آگوست ۲۰۱۱. بازبینیشده در ۲۰ خرداد ۱۳۹۱.